Se ha hinchado y se ha puesto rojo. Quema al tacto. Y duele horrores. Diana masculla mientras se desinfecta el dedo gordo del pie con agua oxigenada. Ayer se clavó un vidrio mientras caminaba descalza por la playa; no le dio mucha importancia y siguió disfrutando del día. Pero parece que la herida se infectó, porque el dolor ha ido en aumento. Como respuesta, su dedo se ha inflamado.

Por la cara de Diana se puede intuir la clase de pensamientos que está dedicando en estos instantes a todo aquél que en algún momento de su vida haya tirado una botella de vidrio en la arena de la playa.
La inflamación es un mecanismo que tiene nuestro cuerpo para defenderse y reparar daños, tanto exógenos como endógenos (en el caso de Diana, el agente dañino es exógeno, ya que se trata de bacterias). Es, por lo tanto, un proceso benigno en la mayoría de los casos, pero en ocasiones puede descontrolarse y causarnos problemas. Bastante serios, de hecho. En esta entrada nos centraremos en el rol defensivo de la inflamación, tomando como ejemplo la respuesta inmune contra una infección bacteriana.
Si recordáis la entrada anterior, dijimos que el sistema inmune tiene dos divisiones: la inmunidad innata y la adaptativa. Ambas participan en la inflamación, pero normalmente la primera suele ostentar el papel principal, que desarrollaremos en esta entrada. En otras palabras, ¿cómo pasó el dedo de Diana de tener un aspecto normal a estar como un tomate?
Una brecha en las defensas
Como vimos en la última entrada, nuestro cuerpo está altamente fortificado. Los epitelios que nos recubren (por fuera y por dentro) constituyen una barrera muy eficiente, pero no perfecta. En el caso de Diana, se rompió por culpa de la herida superficial que le produjo un vidrio.
Al seguir caminando descalza por la playa, el corte entró en contacto con miles, sino millones, de bacterias. Probablemente varias de ellas eran bacterias patógenas, y algunas vieron en la herida de Diana una oportunidad de oro para reproducirse (no todas tienen la capacidad de infectar heridas). Sin pensárselo dos veces, se lanzaron a colonizarla y a multiplicarse en su interior. Un tejido desprotegido es una gran fuente de nutrientes para quien lo sabe aprovechar.

Parece que al bacilo verde (un bacilo es una bacteria con forma alargada, como de bastón) le ha gustado la herida Diana, y ha decidido formar un asentamiento en ella, para horror de las células de su piel. No habría podido franquear la barrera que constituye la epidermis de no haber sido porque el vidrio abrió una brecha.
La voz de alarma
Aunque lo cierto es que no está tan desprotegido como aparenta. Bajo todos nuestros epitelios y situados también en otros lugares estratégicos del cuerpo se esconde una legión de macrófagos tisulares. [1] Éstos son células con una alta capacidad de fagocitar (es decir, devorar) cualquier cuerpo extraño con el que se encuentren. Además, cuentan con numerosos receptores, que vendrían ser como antenitas, que les permiten discernir si aquello con lo que se topan es extraño o propio y cuál es su nivel de peligrosidad. De esta forma pueden detectar fácilmente cualquier grupo de bacterias invasoras para zampárselo antes de que armen un lío. Esto pone fin a la mayoría de intentos de infección, pero a veces no es suficiente.
Es por eso que los macrófagos tienen también otro trabajo: dar la voz de alarma ante la invasión. Ya que suelen ser los primeros en detectar a los atacantes, son también los encargados de producir citoquinas. Como vimos en la última entrada, las citoquinas son moléculas que transmiten mensajes entre células. En este caso, las que emiten los macrófagos significan algo así como “¡Nos atacan! ¡Necesitamos refuerzos!”. Este mensaje se ve reforzado además por otras moléculas fabricadas por estas células, unos lípidos con unos nombres muy raros [a] pero muy relevantes en la inflamación. [1,3] Tanto es así que los fármacos antiinflamatorios más utilizados (como el ibuprofeno o el paracetamol) actúan inhibiendo la síntesis de estos lípidos.
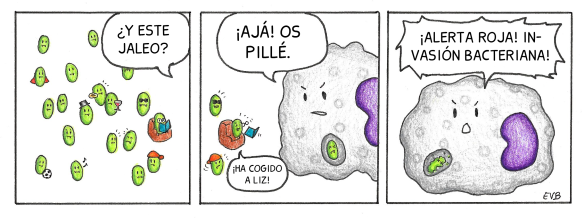
Un macrófago ha interrumpido la fiesta que se estaban montando los bacilos verdes en el dedo de Diana. Gracias a sus receptores ha podido identificarlos como una amenaza y dar la voz de alarma. Él solo no podría contra tantas bacterias.
Refuerzos
El grito de los macrófagos se escucha desde los vasos sanguíneos cercanos al lugar de la infección. Éstos se dilatan, lo que permite que fluya más sangre, pero a la vez también de forma más lenta. Las células endoteliales, que son las que recubren por dentro las paredes de los vasos, se separan ligeramente y se preparan para permitir el paso de los refuerzos. Todo esto es lo que provoca el enrojecimiento y la hinchazón característicos de la inflamación, por la acumulación de sangre y de líquido que sale de los vasos sanguíneos al tejido infectado.
En el entorno de la herida las citoquinas inundan la sangre. Y por la sangre circulan los neutrófilos, los artilleros del sistema inmune. Al llegar al lugar y detectar las citoquinas, se unen a las paredes de los vasos y ruedan pegados a ellas (como una pelota recubierta de velcro por una alfombra), hasta que encuentran un hueco entre células endoteliales que les permita salir. Se deslizan a través de él y rápidamente buscan al enemigo para poner en marcha su ofensiva.
Este proceso es muy eficiente, de forma que los neutrófilos llegan en gran número. Arrasan con todo a su paso: fagocitan y destruyen cualquier bacteria que se encuentren. No temen a la muerte: todos ellos tienen las horas contadas. Una vez se activa y entra en un tejido dañado, un neutrófilo sabe que no vivirá más de uno o dos días. Sin tener nada que perder, luchan encarnizadamente contra cualquier enemigo. Y en un último estertor son capaces de lanzar su propio núcleo al exterior, como una red pegajosa que inmoviliza a las bacterias que haya alrededor, lo que se denomina trampa de cromatina. Sin duda son unos guerreros temibles.

La llegada de citoquinas a los vasos sanguíneos cercanos a la herida provoca que el endotelio se active, lo cual facilita la salida de plasma sanguíneo (los glóbulos rojos no llegan a salir) y de células del sistema inmune como los neutrófilos. El proceso de salida de células inmunitarias se denomina diapédesis.
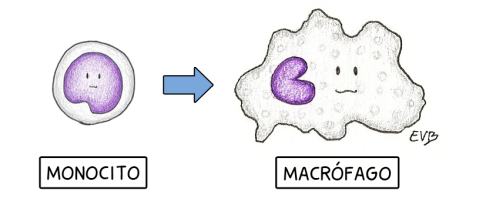
Pero no están solos. A los neutrófilos los sigue una retaguardia de monocitos, que llegan algo más tarde pero de la misma forma. Estas células, que también circulan en la sangre, son los precursores de los macrófagos; es decir, macrófagos antes de madurar. [b] Los últimos son demasiado grandes y deformes (sin ánimo de ofender) para dejarse arrastrar por el flujo sanguíneo, así que son los monocitos, sus versiones más jóvenes, quienes tienen que moverse. Una vez en el tejido infectado maduran y se transforman en enormes e intimidantes macrófagos. Además de ser los mejores zampando microbios, son también los que dirigen el proceso de la inflamación, gracias a su capacidad de enviar mensajes a través de citoquinas y de mediadores lipídicos. [a]
El final de la batalla
Tres días después de la escapada a la playa, el dedo de Diana va volviendo a su tamaño y aspecto normales, para gran alivio por su parte. Afortunadamente, la inflamación es un proceso reversible, y es así porque está autorregulado. Y digo afortunadamente porque la inflamación es un arma de doble filo. Muy eficaz, sin duda, pero la batalla entre neutrófilos, macrófagos y bacterias puede causar serios daños al tejido en que se encuentren. De hecho, es responsabilidad de los macrófagos detectar cuándo cae el enemigo para detener la llegada de más células inmunitarias que no harían sino empeorar las cosas.
Pero no termina aquí su trabajo. También son los encargados de limpiar del campo de batalla los cadáveres de los caídos (mayoritariamente bacterias y neutrófilos), que no son otra cosa que lo que forma el pus, y de dirigir la reparación del tejido, es decir, la cicatrización. Y cuando su deber ha concluido, cuando ya lo han dado todo por proteger el tejido de la infección, los honorables macrófagos, pilares de la batalla, mueren por apoptosis. [3] Se suicidan en silencio para dejar sitio al tejido recién cicatrizado.
La cara oscura de la inflamación
El ejemplo que hemos visto en esta entrada es un algo que ocurre cientos de veces a lo largo de nuestras vidas. Normalmente la inflamación que sufrimos es aguda: bastante molesta, pero delimitada en un espacio corto de tiempo. Sin embargo, lo cierto es que algunas veces los sistemas de regulación fallan por diversos motivos y las cosas se tuercen. Y ya no estamos hablando sólo de infecciones, sino también de lesiones endógenas. En estos casos, la inflamación no se detiene y se cronifica, lo que provoca graves daños en el tejido inflamado. La inflamación crónica se produce en enfermedades como la artritis, la aterosclerosis, el cáncer o el Alzheimer.
Hemos visto que la inflamación es un arma defensiva muy potente, pero puede causar estragos si se descontrola. Así pues, a nivel celular también se podría decir que un gran poder conlleva una gran responsabilidad.
Notas
a. Para los más curiosos, los más importantes de estos lípidos (llamados técnicamente mediadores lipídicos) se denominan eicosanoides y son muy diversos. Se sintetizan a partir de los ácidos grasos esenciales (puede que os suenen los omega-3 y omega-6), por lo que para estar sanos es importante ingerir suficientes cantidades de estas grasas, halladas por ejemplo en los frutos secos o el pescado azul. Se agrupan bajo dos grupos principales: prostanoides (que incluyen prostaglandinas, tromboxanos y prostaciclinas) y leucotrienos. Ahora ya tenéis ideas para colgar hasta a los más pedantes en el ahorcado. Aunque puede que entonces los pedantes paséis a ser vosotros.
b. También son los precursores de parte de las células dendríticas, que vimos en la entrada anterior.
Referencias
1. Murphy K, Travers P, Walport M, Janeway CA. Janeway’s immunobiology. New York: Garland Science; 2008.
2. Murakami M. Lipid mediators in life science. Exp. Anim. 2011;60: 7–20.
3. Gautier EL, Ivanov S, Lesnik P, Randolph GJ. Local apoptosis mediates clearance of macrophages from resolving inflammation in mice. Blood. 2013;122: 2714–2722.

¡Muy buen post, ya lo estaba esperando!
Mientras leía me ha venido la duda de qué es la pus. Se que la has mencionado pero me gustaría entenderla mejor.
Por lo que he entendido, la pus es una acumulación de células muertas, tanto infecciosas como inmunitarias, resultado de la respuesta inmune. Según esta definición, parece que la pus es indicadora del final de una respuesta inmune frente a la infección. ¿No debería haber pus entonces al final de cada infección? ¿O se hace perceptible solo durante las infecciones más graves?
Finalmente… ¿Es la pus exclusiva de un proceso infeccioso o solo con que haya células muertas del organismo es suficiente para que aparezca la pus?
Muchas gracias~ :)
Buena información felicidades :)
Muchas gracias :)
¡Muy interesante y excelentemente explicado!
Gracias por tu claridad y sentido del humor ;)
Que hermoso, muy interesante! Gracias from Brazil!
Gracias por explicar el tema de manera didáctica :)
Qué bonitos dibujos >u< así es más fácil entender :3
Holaaa. Me encanta tu blog, es bello; que alguien me aclare mi duda: los monocitos no son las células presentadoras de antígenos?